โดย … กัลยลักษณ์ เสนาะสำเนียง สมศิริ แสงโชติ และวีระณีย์ ทองศรี
ภาควิชาโรคพืช คณะเกษตร มหาวิทยาลัยเกษตรศาสตร์
เงาะ เป็นผลไม้ที่มีสีสันสวยงาม และรสชาติหวานอร่อย มีคุณค่าทางโภชนาการ จึงเป็นที่ต้องการของตลาดทั้งภายในและต่างประเทศ โดยเฉพาะเงาะพันธุ์โรงเรียน ปัจจุบันประเทศไทยเป็นแหล่งผลิตและส่งออกเงาะรายใหญ่ของโลก โดยมีประเทศคู่ค้าเงาะสดที่สำคัญได้แก่ เวียดนาม สหรัฐอาหรับเอมิเรตส์ และเมียนมา ประเทศคู่ค้าเงาะบรรจุภาชนะอัดลม (เงาะกระป๋อง) ที่สำคัญได้แก่ จีน เมียนมา และกัมพูชา และประเทศคู่ค้าเงาะสอดไส้สับปะรดในน้ำเชื่อมที่สำคัญ ได้แก่ สหรัฐอเมริกา สิงคโปร์ และเมียนมา โดยแหล่งผลิตเงาะอันดับต้นๆ ของประเทศไทยอยู่ในเขตภาคตะวันออก ได้แก่ จังหวัดจันทบุรี ตราด และระยอง (สํานักส่งเสริมและจัดการสินค้าเกษตร, 2561) โดยทั่วไปแล้วการผลิตเงาะมักมีปัญหาความสูญเสียเนื่องจากการมีอายุในการวางจำหน่ายสั้น เพราะผลเงาะมีการเปลี่ยนแปลงทางสรีรวิทยาของเนื้อเยื่อพืชอย่างรวดเร็วกว่าผลไม้ชนิดอื่นๆ ประกอบกับเกิดการเน่าเสียหายของผลเงาะสดเนื่องจากการเข้าทำลายของเชื้อจุลินทรีย์ภายหลังการเก็บเกี่ยวหลายชนิด จึงยิ่งทำให้ผลเงาะมีอายุในการเก็บรักษาสั้นมากขึ้น (O’Hare, 1995) ซึ่งในส่วนของเชื้อจุลินทรีย์ที่ก่อโรคนั้น พบว่าสามารถเข้าทำลายผลเงาะได้ตั้งแต่อยู่ในแปลง โดยส่วนใหญ่มักเป็นกลุ่มของเชื้อรา ด้วยเหตุนี้ จึงมีการใช้สารเคมีป้องกันกำจัดเชื้อราในการควบคุมโรคผลเน่าของเงาะมาอย่างยาวนาน ดังเช่น มีการใช้สารเคมี benomyl และ dichloran ควบคุมโรคผลเน่าหลังการเก็บเกี่ยว แต่พบว่าเฉพาะสารเคมี benomyl เท่านั้นที่ควบคุมโรคผลเน่าของเงาะได้ (นิพนธ์, 2526) นอกจากนี้ยังมีรายงานการจุ่มผลเงาะในสารเคมี benomyl และ iprodione ที่ความเข้มข้น 500 ppm แล้วตามด้วย procloraz ที่ความเข้มข้น 250 ppm เป็นเวลา 30 นาที สามารถลดโรคผลเน่าได้ 42 เปอร์เซ็นต์ (สมศิริ และคณะ, 2540)
อย่างไรก็ตาม การควบคุมโรคหลังการเก็บเกี่ยวของผลผลิตด้วยสารเคมีป้องกันกำจัดเชื้อรา มักพบปัญหาการตกค้างของสารเคมีบนผลิตผล ดังนั้นการควบคุมโรคหลังการเก็บเกี่ยวของผลิตผลหลายชนิดจึงได้มีการนำสารเคมีในกลุ่มที่มีความปลอดภัย (generally recognized as safe compounds) มาใช้ในการควบคุมโรคผลเน่าหลังการเก็บเกี่ยวกันอย่างกว้างขวาง เนื่องจากสารเคมีในกลุ่มดังกล่าวได้ผ่านการรับรองโดยองค์การอาหารและยา (Food and Drug Administration, FAD) ว่าสามารถเติมลงไปในอาหารได้อย่างปลอดภัย จึงทำให้เกิดการตกค้างบนผลผลิตน้อย หรือไม่ตกค้างเลย ซึ่งทำให้เกิดความปลอดภัยต่อผู้ผลิตและผู้บริโภค (Anonymous, 2012) กรดซาลิไซลิกจัดเป็นกรดอินทรีย์ชนิดหนึ่งที่พบได้ในพืชชั้นสูงทั่วไป และจัดเป็นสารเคมีที่มีความปลอดภัยในการนำมาควบคุมโรคพืชหลายชนิด มีความเกี่ยวข้องในกระบวนการต่างๆ ภายในพืช (Klessig and Malamy, 1994) วัตถุประสงค์ของงานวิจัยนี้จึงมีแนวคิดในการนำกรดซาลิไซลิกมาควบคุมโรคผลเน่าภายหลังการเก็บเกี่ยวของเงาะ เพื่อเป็นทางเลือกหนึ่งในการควบคุมโรคของเงาะและไม้ผลหลังการเก็บเกี่ยวชนิดอื่นๆ ต่อไป
เชื้อราสาเหตุโรคผลเน่าของเงาะ
จากการแยกเชื้อราสาเหตุโรคผลเน่าของเงาะพันธุ์โรงเรียนจากแหล่งปลูก 3 จังหวัดทางภาคตะวันออก พบเชื้อราทั้งหมด 7 สกุล ซึ่งจำแนกโดยอาศัยลักษณะสัณฐานวิทยา ได้แก่ Colletotrichum spp., Gliocephalotrichum spp., Greeneria spp., Lasiodiplodia spp., Pestalotiopsis spp., Phoma spp. และ Phomopsis spp. โดยเชื้อราที่พบมากที่สุดตามลำดับ คือ Gliocephalotrichum spp., Pestalotiopsis spp. และGreeneria spp. ซึ่งสอดคล้องกับรายงานในประเทศไทยตั้งแต่ปี พ.ศ 2526 ที่พบว่าผลเงาะที่เก็บจากแหล่งปลูกทางภาคตะวันออกและภาคใต้ มักพบการเข้าทำลายของเชื้อราสกุล Pestalotiopsis และเมื่อผลเงาะมีอายุมากขึ้นมักพบเชื้อราสกุลอื่นๆ เข้าทำลายร่วมด้วยเสมอ เช่น Gliocephalotrichum spp., Phomopsis spp., Colletotrichum gloeosporioides, Lasiodiplodia theobromae และ Phytophthora botryosa (นิพนธ์, 2526; สมศิริ และคณะ, 2540)
นอกจากนี้ยังมีรายงานจากฮาวายที่พบว่าโรคผลเน่าของเงาะเกิดจากเชื้อราหลายสกุล ได้แก่ Lasmenia sp., Colletotrichum sp., Pestalotiopsis sp., Gliocephalotrichum simplex และ Phomopsis sp. (Serrato-Diaz et al., 2013) โดยเชื้อราเหล่านี้ก่อให้เกิดอาการผลเน่า ซึ่งจะเริ่มปรากฏอาการจุดฉ่ำน้ำสีน้ำตาลถึงดำที่บริเวณขั้วหรือผิวของผล จากนั้นแผลจะขยายลุกลามและเน่าเป็นสีดำ บางครั้งพบเส้นใยเชื้อราเจริญฟูขึ้นบนแผล ทำให้เกิดความเสียหายในระยะหลังการเก็บเกี่ยวเป็นจำนวนมาก (ภาพที่ 1)
ทดสอบการก่อโรคของเชื้อรา
คัดเลือกตัวแทนสกุลของเชื้อราที่พบมากที่สุด 3 ลำดับแรก คือ Gliocephalotrichum spp., Pestalotiopsis sp. และ Greeneria spp. มาทดสอบการก่อโรค พบว่า เชื้อรา Gliocephalotrichum sp. มีความสามารถในการก่อโรครุนแรงที่สุด มีเส้นผ่านศูนย์กลางแผล 4.55 เซนติเมตรที่ 3 วันหลังการปลูกเชื้อ (ภาพที่ 2 ก) ในขณะที่การปลูกเชื้อรา Greeneria sp. โดยใช้สปอร์แขวนลอยและชิ้นวุ้นของเชื้อราบนผลเงาะทั้งที่ทำแผลและไม่ทำแผล ก็สามารถทำให้ก่อโรคผลเน่าได้ภายใน 5 วันหลังการปลูกเชื้อ โดยแสดงอาการฉ่ำน้ำและแผลขยายลึกลงไปจนถึงเยื่อหุ้มเมล็ดของผลเงาะ (ภาพที่ 2 ข) ส่วนเชื้อรา Pestalotiopsis sp. ก่อให้เกิดอาการผลเน่าเพียงเล็กน้อยเท่านั้น (ภาพที่ 2 ค)


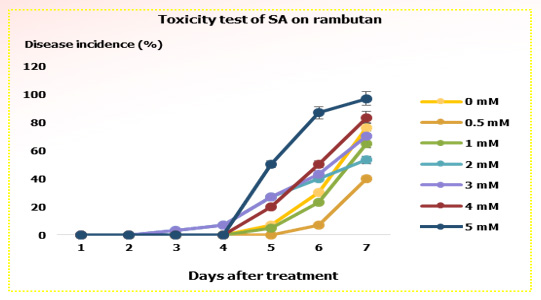
คัดเลือกความเข้มข้นที่เหมาะสมของกรดซาลิไซลิกเพื่อใช้ในการควบคุมโรคผลเน่าของเงาะ
จากการจุ่มผลเงาะในสารละลายกรดซาลิไซลิกที่ความเข้มข้นต่างๆ ได้แก่ 0, 0.5, 1, 1.5, 2, 3, 4 และ 5 มิลลิโมลาร์ เป็นเวลา 5 นาที และเก็บผลเงาะที่อุณหภูมิห้อง เป็นเวลา 7 วัน พบว่าเงาะเริ่มแสดงอาการผลเน่าในวันที่ 3 หลังจากจุ่มสารละลายที่ความเข้มข้น 2 และ 3 มิลลิโมลาร์ โดยพบผลเงาะเน่า 3.3% และเพิ่มขึ้นเป็น 6.7% ในวันที่ 4 ส่วนผลเงาะที่จุ่มในสารละลายที่ระดับความเข้มข้น 0.5 และ 1 มิลลิโมลาร์ สามารถชะลอการเกิดอาการผลเน่าให้ช้าลงได้ โดยเริ่มแสดงอาการที่ 5-6 วันหลังการจุ่มสาร ในส่วนของสารละลายที่มีความเข้มข้นสูงขึ้น (4 และ 5 มิลลิโมลาร์) กลับทำให้เงาะแสดงอาการผลเน่ามากขึ้นตามระยะเวลาที่เก็บรักษายาวนานขึ้น (ภาพที่ 3) กรดซาลิไซลิกที่ความเข้มข้นสูงเกินไปจะทำให้พืชเกิดสภาพเครียด และเนื้อเยื่ออ่อนแอ โดยพบว่ากรดซาลิไซลิกนั้นมีกลไกที่ทำให้เกิดการตายของเซลล์พืช (Derner et al., 1997) ทำให้ง่ายต่อการเข้าทำลายของเชื้อรา สอดคล้องกับรายงานที่ผ่านมาที่พบว่าความเข้มข้นที่เหมาะสมของกรดซาลิไซลิกต่อการนำไปใช้กับสตรอเบอรี่คือ 1-2 มิลลิโมลาร์ ส่วนที่ความเข้มข้น 4 มิลลิโมลาร์เป็นความเข้มข้นที่สูงเกินไปจนทำลายเนื้อเยื่อของผลสตรอเบอรี่ โดยทำให้เซลล์พืชมีการหายใจและสังเคราะห์เอทธิลีนเพิ่มมากขึ้น (Babalar et al., 2007) ดังนั้นจากผลการทดลองข้างต้น จึงได้คัดเลือกสารละลายกรดซาลิไซลิกที่ระดับความเข้มข้น 1 มิลลิโมลาร์ ซึ่งเป็นความเข้มข้นสูงสุดที่ทำให้เงาะเกิดอาการผลเน่าช้ากว่าที่จุ่มในความเข้มข้นอื่นๆ มาใช้ในการทดลองต่อไป
ผลของกรดซาลิไซลิกต่อการควบคุมโรคผลเน่าของเงาะ
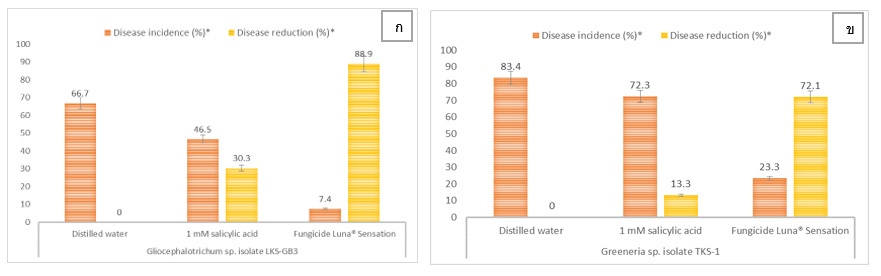
การจุ่มผลเงาะในสารละลายกรดซาลิไซลิกที่ระดับความเข้มข้น 1 มิลลิโมลาร์ และปลูกเชื้อราที่ใช้เป็นตัวแทนในการศึกษา พบว่ากรดซาลิไซลิก สามารถยับยั้งการเกิดโรคผลเน่าที่เกิดจากเชื้อรา Gliocephalotrichum spp. ได้ดีกว่าผลเน่าที่เกิดจากเชื้อรา Greeneria sp. โดยยับยั้งได้ 30.3 และ 13.3 เปอร์เซ็นต์ ตามลำดับ ในขณะที่สารเคมีป้องกันกำจัดเชื้อรา Luna® Sensation สามารถยับยั้งการเกิดโรคได้มากกว่า 70 เปอร์เซ็นต์ ส่วนประสิทธิภาพในการยับยั้งความรุนแรงของโรค พบว่า สารละลายกรดซาลิไซลิกสามารถยับยั้งความรุนแรงของโรคที่เกิดจากเชื้อราทั้ง 2 สกุลได้อย่างไม่มีความแตกต่างกันทางสถิติ (20 – 27.1 เปอร์เซ็นต์) ในขณะที่สารเคมีป้องกันกำจัดเชื้อรา Luna® Sensation สามารถยับยั้งการเกิดโรคได้มากกว่า 70 เปอร์เซ็นต์ (ภาพที่ 4ก, 4ข) กรดซาลิไซลิกเป็นสารกระตุ้นที่ช่วยชักนำให้พืชเกิดความต้านทานต่อโรค และช่วยลดการเกิดโรคของผลิตผลหลังการเก็บเกี่ยวหลายชนิด เช่น โรคผลเน่าราสีเทาของสตรอเบอร์รี่ที่เกิดจากเชื้อรา Botrytiscinerea และช่วยคงคุณภาพของผลสตรอเบอรี่โดยไปลดการสังเคราะห์เอทธิลีนซึ่งทำให้ผลผลิตมีอายุการเก็บรักษายาวนานขึ้น (Babalar et al., 2007) โดยสารดังกล่าวมีกลไกในการกระตุ้นกิจกรรมของเอนไซม์ที่มีความเกี่ยวข้องกับความต้านทานโรคของพืชให้สูงขึ้น เช่น β-1,3-glucanase, phenylalanine ammonia lyase (PAL), polyphenol oxidases (PPO) และ peroxidase (POD) ซึ่งเอนไซม์เหล่านี้มีความเกี่ยวข้องกับการผลิตสาร phenolics ในเนื้อเยื่อพืชที่มีคุณสมบัติไปยับยั้งการเจริญของเชื้อราสาเหตุโรค และช่วยลดความรุนแรงของโรคได้ (Yao and Tian, 2005; Yu et al., 2007) นอกจากนี้กรดซาลิไซลิกยังช่วยยับยั้งกิจกรรมของเอนไซม์ catalase ที่ทำหน้าที่สลาย H2O2 จึงทำให้พืชมีการสะสม H2O2 ที่จะไปกระตุ้นกระบวนการต่างๆ ได้แก่ การหายใจ การสังเคราะห์แสง และการเกิดการตายของเซลล์อย่างเฉียบพลัน (hypersensitive cell death) เพื่อป้องกันการรุกรานของเชื้อสาเหตุโรค รวมทั้ง H2O2 ยังทำหน้าที่เป็นโมเลกุลส่งสัญญาณตัวที่ 2 (secondary messenger) ที่จะไปกระตุ้นการแสดงออกของ PR genes ทำให้เกิดการสังเคราะห์โปรตีนที่มีความเกี่ยวข้องกับการเกิดโรค (pathogenesis related proteins) ในพืช ซึ่งทำให้พืชเกิดความต้านทานต่อเชื้อก่อโรคได้ดียิ่งขึ้น (Derner et al., 1997) กรดซาลิไซลิกยังมีคุณสมบัติในการยับยั้งการเจริญของเชื้อสาเหตุโรคโดยตรงเช่นเดียวกับสารเคมีป้องกันกำจัดโรคพืช แต่ยับยั้งได้ในประสิทธิภาพที่ต่ำกว่า (Yao and Tian, 2005) นอกจากนี้ กรดซาลิไซลิกสามารถนำไปใช้ควบคุมโรคพืชร่วมกับวิธีการอื่นๆ เพื่อเพิ่มประสิทธิภาพในการควบคุมโรคให้ดียิ่งขึ้น เช่น ใช้ร่วมกับการจุ่มน้ำร้อน สารละลายโซเดียมไบคาร์บอเนต สารละลายแคลเซียม หรือเซลล์แขวนลอยของยีสต์ปฏิปักษ์ (Shafiee et al., 2010; Qin et al., 2015) เป็นต้น
บทความนี้ตีพิมพ์ลงใน Postharvest Newsletter ปีที่ 19 ฉบับที่ 4 ตุลาคม – ธันวาคม 2563
เอกสารอ้างอิง
นิพนธ์ วิสารทานนท์. 2526. โรคราแป้งและโรคผลเน่าของเงาะระยะหลังเก็บเกี่ยวและการป้องกันกำจัดด้วยสารเคมี, น.
393-401, ใน การประชุมทางวิชาการมหาวิทยาลัยเกษตรศาสตร์ ครั้งที่ 21 สาขาพืช, มหาวิทยาลัยเกษตรศาสตร์, กรุงเทพฯ
สํานักส่งเสริมและจัดการสินค้าเกษตร. 2561. ผลพยากรณ์การผลิตพืชไร่ ไม้ยืนต้น และไม้ผลที่สำคัญปี (เงาะ). [ออนไลน์]. แหล่งที่มา:
http://www.agriman.doae.go.th/home/news/2562/21-22.pdf, (12 กรกฎาคม 2563).
สมศิริ แสงโชติ, อุดม ฟ้ารุ่งสาง, และ นวลวรรณ ฟ้ารุ่งสาง. 2540. การเข้าทำลายของผลเงาะก่อนและหลังการเก็บเกี่ยว
ของเชื้อราที่เป็นสาเหตุโรคผลเน่า และการควบคุมโรคผลเน่าภายหลังการเก็บเกี่ยว, น. 393-401, ใน การประชุมทาง
วิชาการของมหาวิทยาลัยเกษตรศาสตร์ ครั้งที่ 3 สาขาพืช ส่งเสริมและนิเทศศาสตร์เกษตร อุตสาหกรรมเกษตร,
มหาวิทยาลัยเกษตรศาสตร์, กรุงเทพฯ.
Anonymous. 2012. Generally Recognized as Safe (GRAS) FDA. Gov. [Online]. Available Source:
https://www.fda.gov/media/133657/download, (September 6, 2018).
Derner, J., J. Shah and D.F. Klessing. 1997. Salicylic acid and disease resistance in plant. Trends in Plant Science 2: 266-274.
O’Hare, T.J. 1995. Postharvest physiology and storage of rambutan. Postharvest Biology and Technology 6: 189-199.
Qin, X., H. Xiao, C. Xue, Z. Yu, R. Yang, Z. Cai and L. Si. 2015. Biocontrol of gray mold in grapes
with the yeast hanseniaspora uvarum alone and in combination with salicylic acid or sodium
bicarbonate, Postharvest Biology and Technology 100: 160–167.
Klessig, D. F. and J. Malamy. 1994. The salicylic acid signal in plants. Plant Molecular Biology 26: 1439-1458.
Serrato-Diaz L.M., L.I. Rivera-Vargas, R.J. Goenaga and R.D. French-Monar. 2013. Identification of the
fungal pathogen complex causing fruit rot of rambutan (Nephelium lappaceum L.) in Puerto Rico.
Phytopathology. 103: S2.130.
Shafiee, M., T.S. Taghavi and M. Babalar. 2010. Addition of salicylic acid to nutrient solution
combined with postharvest treatments (hot water, salicylic acid, and calcium dipping) improved
postharvest fruit quality of strawberry. Scientia Horticulturae 124: 40–45.
Babalar, M., M. Asghari, A. Talaei and A. Khosroshahi. 2007. Effect of pre- and postharvest salicylic
acid treatment on ethylene production, fungal decay and overall quality of selva strawberry fruit.
Food Chemistry 105: 449-453.
Yao, H. and S. Tian. 2005. Effects of pre- and post-harvest application of salicylic acid or methyl
jasmonate on inducing disease resistance of sweet cherry fruit in storage. Postharvest Biology and Technology
35 (3): 253-262.
Yu, T., C. Jishuang, C. Rongle, H. Bin, L. Donghong and Z. Xiaodong. 2007. Biocontrol of blue and
gray mold diseases of pear fruit by integration of antagonistic yeast with salicylic acid, Inter. Journal of Food
Microbiology 116: 339-345.



